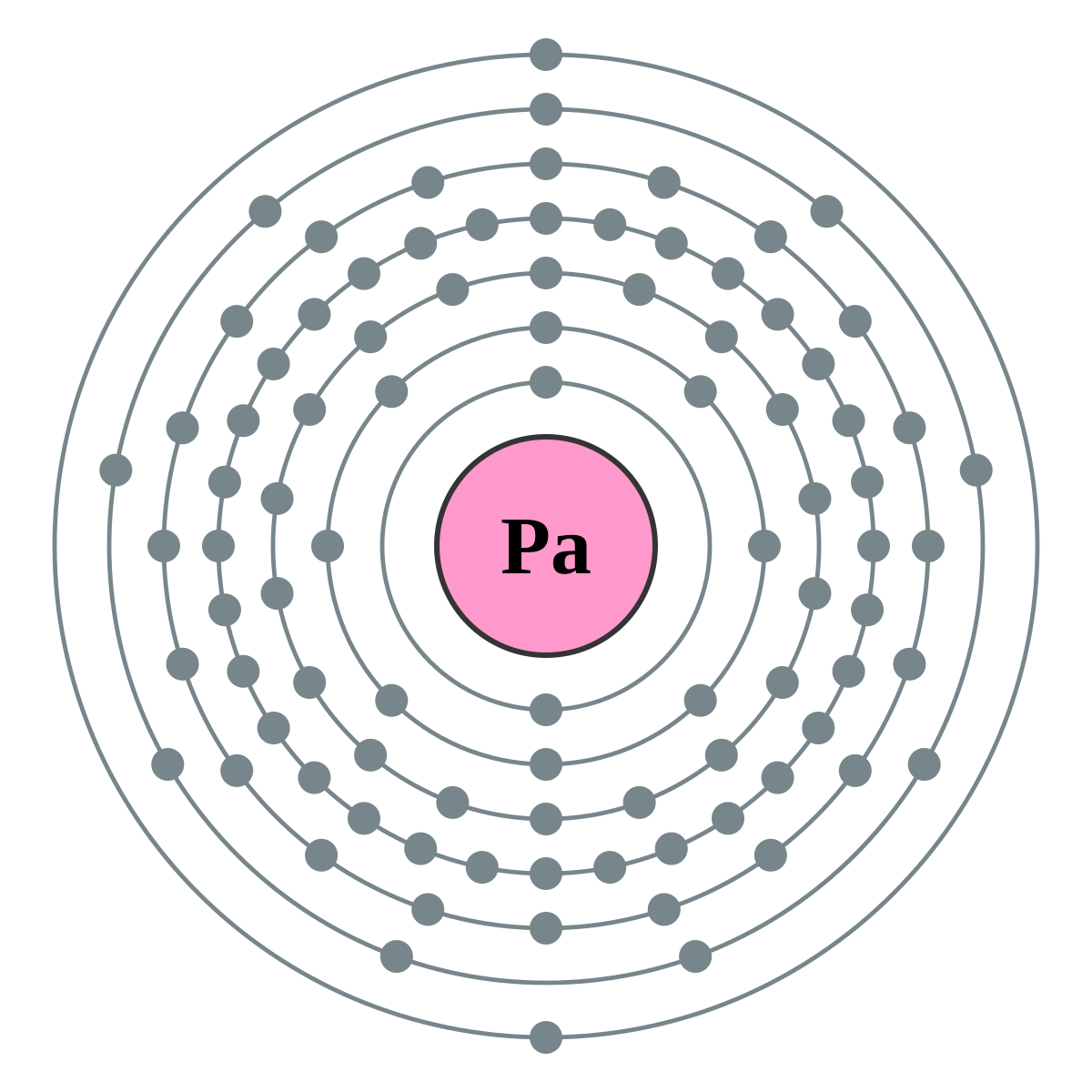
Protaktinium (chemická značka Pa, latinsky Protactinium) je třetím členem z řady aktinoidů, radioaktivní kovový prvek.
Základní fyzikálně-chemické vlastnosti
Protaktinium je radioaktivní kovový prvek stříbřitě bílé barvy, která se působením vzdušného kyslíku mění na šedavou. Hlavní izotop protaktinia 231Pa je α-zářič.
Ve sloučeninách se vyskytuje v mocenství od Pa+3 po Pa+5, přičemž nejstálejší jsou sloučeniny s oxidačním číslem Pa+5, které se svým chemickým chováním podobají sloučeninám tantalu nebo niobu.
Čistý kov lze připravit redukcí fluoridu protaktiničného kovovým baryem při teplotě kolem 1400 °C.
Historie
Jako první identifikovali protaktinium (jaderný izomer 234mPa s poločasem rozpadu1,17 minuty) Kasimir Fajans a O. H. Göhring jako produkt rozpadu uranu 238U. Pojmenovali jej brevium podle krátké doby života (latinsky brevis – krátký).
Za objevitele protaktinia jsou však obvykle označováni Otto Hahn a Lise Meitner z Německa a Frederick Soddy a John Cranston z Velké Británie, kteří roku 1918nezávisle na sobě oznámili objev izotopu 231Pa s mnohem delším poločasem rozpadu. Jméno prvku bylo změněno na protaktinium v roce 1949.
Výskyt, izotopy a využití
V zemské kůře se můžeme setkat pouze s velmi nízkými obsahy izotopu 231Pa, který je produktem radioaktivního rozpadu uranu. Poločas rozpadu tohoto izotopu je 32 760 let a proto i v nejbohatších uranových rudách nacházíme protaktinium v množství maximálně 1–3 ppm (mg/kg).
Z dalších izotopů stojí za zmínku např. 230Pa s poločasem rozpadu 17,4 dne nebo 233Pa s poločasem 26,975 dnů. Celkově je známo 30 izotopů protaktinia:
| Izotop | Poločas přeměny | Druh rozpadu | Produkt rozpadu |
|---|---|---|---|
| 211Pa | >300 ns | α | 207Ac |
| 212Pa | 5,1 ms | α | 208Ac |
| 213Pa | 5,3 ms | α | 209Ac |
| 214Pa | 17 ms | α | 210Ac |
| 215Pa | 14 ms | α | 211Ac |
| 216Pa | 150 ms | α (98 %)/ ε (2 %) | 212Ac/ 216Th |
| 217Pa | 3,6 ms | α | 213Ac |
| 218Pa | 113 μs | α | 214Ac |
| 219Pa | 53 ns | α | 215Ac |
| 220Pa | 0,78 μs | α (100,00 %)/ ε (3,0×10−7 %) | 216Ac/ 220Th |
| 221Pa | 5,9 μs | α | 217Ac |
| 222Pa | 2,9 ms | α | 218Ac |
| 223Pa | 5,1 ms | α | 219Ac |
| 224Pa | 846 ms | α | 220Ac |
| 225Pa | 1,7 s | α | 221Ac |
| 226Pa | 1,8 min | α (74 %)/ ε (26 %) | 222Ac/ 226Th |
| 227Pa | 38,3 min | α (85 %)/ ε (15 %) | 223Ac/ 227Th |
| 228Pa | 22,4 h | ε (98,15 %)/ α (1,85 %) | 228Th / 224Ac |
| 229Pa | 1,5 d | ε (99,52 %)/ α (0,48 %) | 229Th/ 225Ac |
| 230Pa | 17,4 d | ε (92,20 %)/ β− (7,80 %)/ α (3,2×10−3 %) | 230Th/ 230U/ 226Ac |
| 231Pa | 32 760 r | α (100 %) / SF (<3×10−10) | 227Ac / různé |
| 232Pa | 1,32 d | β− / ε | 232U / 232Th |
| 233Pa | 26,975 d | β− | 233U |
| 234Pa | 6,70 h | β− | 234U |
| 235Pa | 24,4 min | β− | 235U |
| 236Pa | 9,1 min | β− | 236U |
| 237Pa | 8,7 min | β− | 237U |
| 238Pa | 2,28 min | β− | 238U |
| 239Pa | 1,8 h | β− | 239U |
| 240Pa | ? | β− | 240U |
První izolace oxidu protaktinia Pa2O5 byla uskutečněna roku 1927, kdy Aristid V. Grosse připravil přibližně 2 mg látky. Elementární kov byl získán roku 1934 termickým rozkladem jodidu protaktinia na elektricky zahřívaném kovovém vlákně ve vakuu:
- 2 PaI5 → 2 Pa + 5 I2
Největší množství čistého prvku bylo připraveno v roce 1961 pod patronací Úřadu pro atomovou energii Velké Británie. Bylo přitom zpracováváno asi 60 tun kalů zbylých po extrakci uranu z konžských rud. Separační proces sestával z dvanácti kroků (loužení kyselinami, kapalinová extrakce, separace na ionexech atd.) a výsledkem bylo 125 g kovového protaktinia o čistotě 99,9 %.
Uvádí se, že náklady na tento proces se pohybovaly kolem půl milionu amerických dolarů a získané množství protaktinia dodnes uspokojuje celosvětovou poptávku po tomto prvku. To jasně ukazuje i na to, že praktický význam protaktinia je zanedbatelný a jeho využití se omezuje pouze na speciální vědecké experimenty.
Budoucí význam protaktinia a především izotopů 233Pa a 234Pa záleží na rozšíření solných reaktorů. Z 233Pa vznikajícího záchytem neutronu jádrem thoria 232Th se jeho rozpadem získává izotop uranu 233U, který je perspektivní náhradou 235U.
| Obecné | |||||||
|---|---|---|---|---|---|---|---|
| Název, značka, číslo | Protaktinium, Pa, 91 | ||||||
| Cizojazyčné názvy | lat. Protactinium | ||||||
| Skupina, perioda, blok | 7. perioda, blok f | ||||||
| Chemická skupina | Aktinoidy | ||||||
| Koncentrace v zemské kůře | 1×10−6 ppm | ||||||
| Vzhled | stříbrný kov | ||||||
| Identifikace | |||||||
| Registrační číslo CAS | 7440-13-3 | ||||||
| Atomové vlastnosti | |||||||
| Relativní atomová hmotnost | (231,035 9) | ||||||
| Kovalentní poloměr | 161 pm | ||||||
| Iontový poloměr | (Pa3+) 106 pm (Pa4+) 91 pm (Pa5+) 88 pm |
||||||
| Elektronová konfigurace | [Rn] 5f2 6d1 7s2 | ||||||
| Oxidační čísla | II, III, IV, V | ||||||
| Elektronegativita(Paulingova stupnice) | 1,5 | ||||||
| Ionizační energie | |||||||
| První | 5,60 eV | ||||||
| Druhá | 11,3 eV | ||||||
| Třetí | 20,5 eV | ||||||
| Čtvrtá | 36,4 eV | ||||||
| Látkové vlastnosti | |||||||
| Krystalografická soustava | α-modifikace čtverečná tělesně centrovaná a= 388,9 pm c= 341,7 pm β-modifikace krychlová a = 381 pm |
||||||
| Molární objem | 15,18×10−6 m3/mol | ||||||
| Teplota změny modifikace | 1 170 °C (α → β) °C(1 443,15 K) | ||||||
| Mechanické vlastnosti | |||||||
| Hustota | 15,374 g/cm3 (mod. α, 20 °C) 13,87 g/cm3 (mod. β) |
||||||
| Skupenství | pevné | ||||||
| Termické vlastnosti | |||||||
| Tepelná vodivost | 47 W⋅m−1⋅K−1 | ||||||
| Součinitel délkové roztažnosti | 99×10−7 (mod. α) | ||||||
| Molární atomizační entalpie | 607,2 kJ/mol | ||||||
| Standardní molární entropieS° | 51,9 J K−1 mol−1 | ||||||
| Termodynamické vlastnosti | |||||||
| Teplota tání | přibližně 1 600 °C (přibližně 1 600 K) | ||||||
| Teplota varu | přibližně 3 300 °C (přibližně 3 300 K) | ||||||
| Specifické teplo tání | 14,65 kJ/mol | ||||||
| Specifické teplo varu | 460,5 kJ/mol | ||||||
| Měrná tepelná kapacita | 0,121 J/g (25 °C) 0,099 J/g (plyn) |
||||||
| Elektromagnetické vlastnosti | |||||||
| Elektrická vodivost | 5,56×106 S/m | ||||||
| Měrný elektrický odpor | 177×10−9 Ωm | ||||||
| Teplota přechodu do supravodivého stavu | 1,5 K | ||||||
| Magnetickéchování | paramagnetický | ||||||
| Bezpečnost | |||||||
 Radioaktivní |
|||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). |
|||||||
|
|||||||



Napsat komentář