Astat (chemická značka At, latinsky Astatinum) je druhým nejtěžším známým prvkemze 17. skupiny (halogeny), existuje pouze ve formě nestabilních radioaktivních izotopů. Název pochází ze starořeckého ἄστατος „nestálý“.
Základní fyzikálně-chemické vlastnosti
Astat nemá žádný stabilní izotop a v přírodě se vyskytuje jen v naprosto nepatrných množstvích jako člen některé z uranových, popř. thoriové rozpadové řady, přičemž se sám velmi rychle dále radioaktivně přeměňuje. Byl proto objeven teprve roku 1940pomocí cyklotronem iniciované přeměny izotopu bismutu 209Bi.
V současné době je známo přibližně dvacet radioizotopů astatu, z nichž nejstabilnější 210At má poločas rozpadu 8,1 hodiny. Kvůli této nestabilitě jader astatu nebylo doposud nikdy připraveno takové množství tohoto prvku, které by umožnilo podrobnější studium jeho fyzikálního a chemického chování. Vědci odhadují, že má černý povrch, ale nikdo to neví jistě.
Historie
Existence eka-jódu byla předpovězena již Mendělejevem. Astat byl poprvé připraven v roce 1940 na University of California v Berkeley ostřelováním bismutu částicemi alfa.
Sloučeniny
Mnoho sloučenin astatu bylo připraveno a studováno v mikroskopickém množství, protože se velmi rychle rozpadají vlivem radioaktivity. Využití těchto sloučenin je hlavně pro teoretické studie, ale předpokládá se i možné využití v nukleární medicíně.
Kyseliny
Nejsou známy žádné kyseliny odvozené od astatu, protože astat nemá žádný stabilní izotop, a proto není kyselina astatovodíková známa.
Izotopy
Astat má 39 známých izotopů, všechny jsou radioaktivní. Jejich nukleonová čísla se pohybují v rozmezí 191 až 229. Také známe 23 metastabilních excitovaných stavů. Nejdéle žijícím izotopem je 210At s poločasem rozpadu 8,1 hodiny. Nejkratší poločas rozpadu ze známých izotopů má 213At (125 ns).
| Obecné | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Název, značka, číslo | Astat, At, 85 | |||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Astatinum, Astatium | |||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 17. skupina, 6. perioda, blok p | |||||||||||||||||||||||||||||||||||||
| Chemická skupina | Halogeny | |||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-68-8 | |||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 210 | |||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 150 pm | |||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 202 pm | |||||||||||||||||||||||||||||||||||||
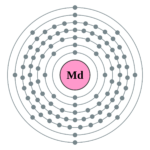
| Elektronová konfigurace | [Xe] 4f14 5d10 6s26p5 | |||||||||||||||||||||||||||||||||||||
| Oxidační čísla | −I, +I, +III, +V, +VII | |||||||||||||||||||||||||||||||||||||
| Elektronegativita(Paulingova stupnice) | 2,2 | |||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||
| První | 899,003 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||
| Hustota | 6,2 až 6,5 g/cm3 | |||||||||||||||||||||||||||||||||||||
| Skupenství | pevné | |||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 1,7 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||
| Teplota tání | 302 °C (575,15 K) | |||||||||||||||||||||||||||||||||||||
| Teplota varu | 337 °C (610,15 K) | |||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||
 Radioaktivní |
||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||




Napsat komentář